L’autorisation de mise sur le marché d’un OGM est délivrée au niveau de l’Union européenne (UE). En effet, cette autorisation implique la libre circulation des produits autorisés sur l’ensemble du territoire de l’Union européenne, et tous les États membres sont donc concernés.
En fonction de la (ou des) utilisation(s) prévues de l’OGM, deux procédures peuvent s’appliquer:
- Pas d'utilisation comme aliment pour l'homme ou l'animal: Mise sur le marché dans le cadre de la directive 2001/18/CE
- Alimentation pour l'himme ou l'animal: Mise sur le marché dans le cadre du règlement (CE) 1829/2003
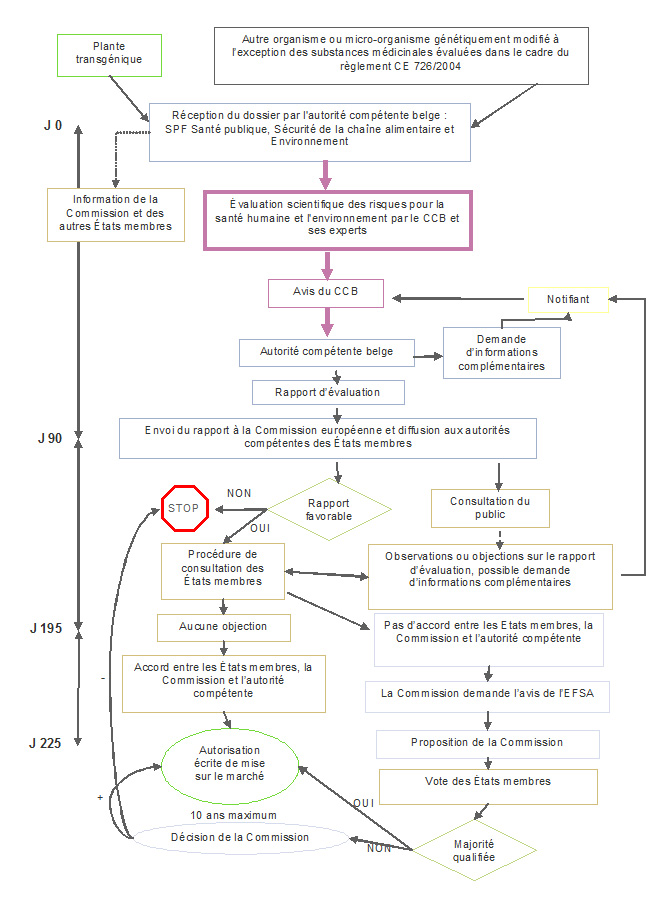
Procédure 1: Mise sur le marché dans le cadre de la directive 2001/18/CE
(d’application uniquement dans les cas où le champ d’application de la notification ne comprend pas une utilisation comme aliment pour l’homme ou l’animal)
Exemples: OGM disséminés en plein air à des fins industrielles (par exemple des arbres génétiquement modifiés pour l'industrie du papier ou de l'amidon), pour la production d'énergie (biocarburants), pour la bioremédiation (par exemple micro-organismes GM pour décomposer des contaminants), pour l'amélioration du paysage, pour usage ornemental (par exemple des œillets GM coupés), pour le contrôle des ravageurs (par exemple insectes GM stériles).
Comment introduire une demande ?
La procédure d’autorisation se fonde sur une interaction entre les autorités nationales et la Commission européenne, impliquant une phase nationale suivie d’une phase communautaire. Le demandeur dépose un dossier auprès de l’autorité nationale compétente d’un État membre de l’UE. Celui-ci devient l’État membre rapporteur pour ce dossier et effectue une évaluation initiale du dossier concerné.
En parallèle, une synthèse de la notification (SNIF – "summary notification information format") est transmis à la Commission européenne qui la rend accessible au public.
|
Une notification pour une demande de mise sur le marché est un dossier très complexe. Elle doit contenir les informations spécifiées à l’article 13 de la directive 2001/18/CE, en particulier :
|
L’Etat membre rapporteur prépare un rapport d’évaluation qu’il fait parvenir à la Commission, laquelle le transmet aux autres États membres pour commentaires. A ce stade, la procédure d’évaluation se déroule au niveau de l’UE, période pendant laquelle les autres États membres peuvent demander des informations complémentaires, faire des observations ou émettre des objections en rapport avec la notification. Si des objections sont émises et maintenues, la Commission sollicite alors l’avis de l’Autorité européenne de sécurité des aliments (EFSA).
Interventions du Conseil consultatif de Biosécurité et du SBB
Lorsque la Belgique est choisie comme Etat membre rapporteur pour un dossier, le Conseil de Biosécurité (CCB) prend en charge l’évaluation des risques (voir section "Quelques chiffres").
L’essentiel des dossiers traités par la Belgique dans le cadre de la directive 2001/18/CE (et précédemment dans le cadre de la directive 90/220/CEE) concerne des dossiers introduits via d’autres États membres (voir aussi section "Quelques chiffres").
L’évaluation de ces dossiers est dans la plupart des cas effectuée par le SBB sur mandat du CCB. Le SBB contribue à deux niveaux de la procédure d’autorisation :
- une fois le rapport d’évaluation transmis par l’État membre rapporteur, les autres États membres disposent d’un délai de 60 jours pour formuler d’éventuelles remarques ou objections ;
- si des objections ont été soulevées, des compléments d’informations sont demandés au notifiant et les États membres disposent à nouveau de 45 jours pour maintenir ou lever leurs objections.
Sur base du rapport d’évaluation et éventuellement de l’opinion de l’EFSA, la Commission européenne propose aux États membres d'accorder ou de refuser l'autorisation. La majorité qualifiée est requise pour approuver la proposition de la Commission. Si aucune majorité qualifiée ne peut être dégagée entre les États membres (premièrement au Comité réglementaire prévu par la directive 2001/18/CE, ensuite dans le cadre du comité d'appel), la décision finale est prise par la Commission.
Les autorisations sont valables pour un maximum de 10 ans (renouvelable).
En vertu de la nouvelle directive (UE) 2015/412 les États membres ont la possibilité de restreindre ou d'interdire la culture d'OGM sur leur territoire, soit au cours de la procédure d'autorisation, soit après qu’un OGM ait été autorisée à la culture dans l'UE.
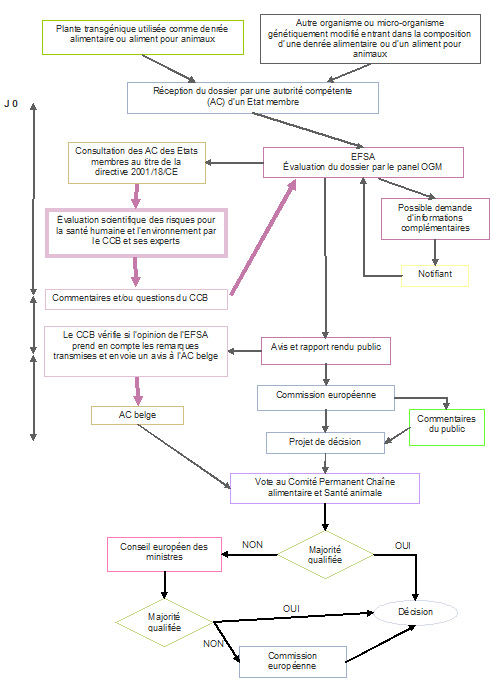
Procédure 2: Mise sur le marché dans le cadre du règlement (CE) 1829/2003
(obligatoire lorsque le champ d’application de la notification couvre l’utilisation comme aliment pour l’homme ou l’animal)
Exemples: Plantes GM utilisées comme denrées alimentaires et/ou aliments pour animaux ; enzymes, additifs, vitamines et arômes pour l’alimentation humaine ou animale contenant, consistant en, ou produits à partir d'OGM (y compris à partir de micro-organismes GM); biomasses utilisées comme matières premières.
Comment introduire une demande ?
La mise sur le marché d’OGM destinés à l’alimentation humaine ou animale est régie par le règlement (CE) 1829/2003. Les dossiers concernent soit des nouveaux OGM, soit des demandes de renouvellement d'autorisation introduites conformément à l'article 11 du règlement et relatives à des OGM autorisés précédemment dans le cadre de la directive 90/220/EEC ou du règlement (CE) 258/97 et dont l'autorisation arrive à échéance.
La procédure d’évaluation des risques est centralisée. La demande est adressée initialement à l'autorité compétente d’un État membre mais le dossier est immédiatement transmis à l’Autorité européenne de sécurité des aliments (EFSA) qui prend en charge l’évaluation scientifique des risques.
Si la notification couvre aussi la mise en culture, le notifiant peut introduire son dossier (i) soit uniquement dans le cadre du règlement (CE) 1829/2003, ou (ii) soit à la fois dans le cadre de la directive 2001/18/CE (pour les aspects mise en culture) et dans le cadre du règlement (CE) 1829/2003 (pour les aspects alimentaires). La première option a toujours été privilégiée à ce jour. Lorsque qu’une notification introduite dans le cadre du règlement (CE) 1829/2003 couvre la mise en culture, l’EFSA doit déléguer l’évaluation des risques pour l’environnement à un Etat membre, qui envoie à l’EFSA sont rapport d’évaluation.
| Une demande d’autorisation pour un OGM destiné à l’alimentation humaine ou animale doit répondre aux exigences définies dans le règlement (CE) 1829/2003 ainsi que celles définies dans le règlement d’exécution (UE) no 503/2013 de la Commission. L’EFSA a également publié des lignes directrices afin d’aider les notifiants à soumettre un dossier de notification de plantes GM destinées à l’alimentation humaine ou animale, à l’importation, à la transformation, et/ou à la mise en culture dans l’UE dans le cadre du règlement (CE) 1829/2003. |
L’EFSA effectue l’évaluation des risques et rédige un avis (publié dans le "EFSA Journal"), à l'attention de la Commission européenne et des Etats membres. Les évaluations de l’EFSA sont réalisées par le Panel OGM, composé d’experts scientifiques indépendants assistés par des groupes de travail spécialisés.
L’avis de l’EFSA est également mis à disposition du public qui dispose de 30 jours pour envoyer des commentaires via le site ad hoc de la Commission européenne.
L'EFSA s'efforce de rendre son avis dans les six mois qui suivent la réception d'une demande. Toutefois, il s’écoule généralement plusieurs mois, voire plusieurs années, entre l'introduction d'un dossier par le demandeur et la publication par l'EFSA de son opinion finale. Ces délais très longs s'expliquent souvent par des demandes de l'EFSA au notifiant de fournir des informations ou des données expérimentales supplémentaires.
Le règlement "aliments GM" prévoit une contribution des États membres au processus d’évaluation des risques (article 6.4). Les États membres peuvent soumettre à l’EFSA des observations sur les dossiers durant une période de consultation de 90 jours (procédure de consultation obligatoire des autorités compétentes de la directive 2001/18/CE). Lorsqu'elle publie par la suite son opinion, l’EFSA doit indiquer en annexe de celle-ci comment chacun des commentaires des États membres ont été pris en compte dans l'opinion correspondante.
Interventions du Conseil consultatif de Biosécurité et du SBB
Le Conseil de Biosécurité (CCB), avec le soutien scientifique de ses experts externes et du SBB, participe à la procédure de consultation de 90 jours pour tous les dossiers introduits dans le cadre du règlement et qui concernent des organismes génétiquement modifiés. Les dossiers portant uniquement sur des produits dérivés (farines, huiles, sucres…) ne sont pas examinés par le Conseil.
Le CCB a également effectué l’évaluation des risques pour l’environnement pour trois dossiers relatifs à des maïs GM (voir section « Quelques chiffres »).
D’autre part, depuis fin 2005, le ministre compétent a chargé le CCB de lui délivrer un avis en complément de l’opinion finale publiée par l’EFSA, et ceci pour tous les dossiers introduits via le règlement "aliments GM". Cet avis porte sur tous les aspects de la notification (caractérisation moléculaire, impact environnemental, analyse nutritionnelle et compositionnelle, toxicité et allergénicité). C’est essentiellement sur la base de cet avis et de l’opinion de l’EFSA que les autorités belges définissent leur position sur les projets de décision de la Commission européenne.
Sur base de l’opinion de l’EFSA, la Commission européenne propose aux États membres d'accorder ou de refuser l'autorisation. La majorité qualifiée est requise pour approuver la proposition de la Commission. Si aucune majorité qualifiée ne peut être dégagée entre les États membres (premièrement au « Standing Committee on Plants, Animals, Food and Feed », ensuite dans le cadre du comité d'appel), la décision finale est prise par la Commission.
Les autorisations sont valables pour un maximum de 10 ans (renouvelable).
